论文题目:Development of an efficient root transgenic system for pigeon pea and its application to other important economically plants
杂志:Plant Biotechnology Journal(IF=6.84,TOP期刊)
背景:
农杆菌(Agrobacterium)是普遍存在于土壤中的一种革兰氏阴性细菌,它能在自然条件下趋化性地感染大多数双子叶植物的受伤部位,并诱导产生冠瘿瘤或发状根[1]。土壤杆菌是常见的植物病原体,具有把它们的DNA片段转给植物的能力,这一属性已经被植物科学家用于制造转基因农作物,即基因修饰农作物[2, 3]。其中,根癌农杆菌(Agrobacterium tumefaciens)和发根农杆菌(Agrobacterium rhizogenes)细胞中分别含有Ti质粒和Ri质粒,其上有一段T-DNA,农杆菌通过侵染植物伤口进入细胞后,可将T-DNA插入到植物基因组中(图1)。因此,农杆菌是一种天然的植物遗传转化体系[4, 5]。
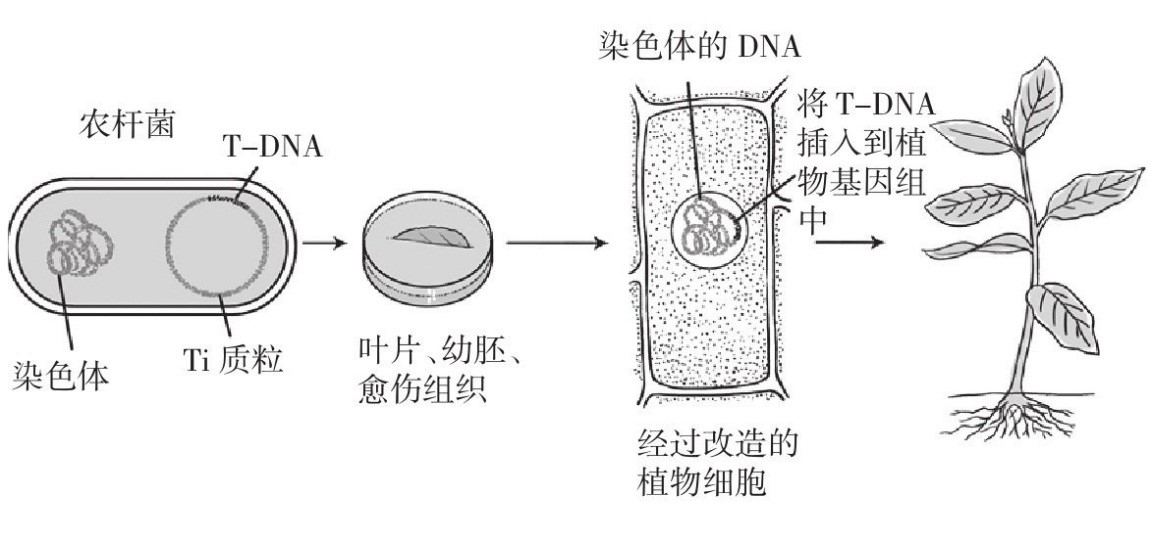
图1 农杆菌介导法过程
然而,传统农杆菌介导法只能在部分模式植物及少数作物中完成稳定的转基因体系,多数还是不稳定的。木本植物生长缓慢,并且缺乏快速、高效、稳定的转基因体系,导致木本植物的研究严重受阻,因此如何建立一种高效、快速、稳定的木本植物转基因体系尤为重要[6]。本研究中,作者提出通过发根农杆菌法侵染木本植物后,通过感染携带修饰的Ri质粒的发根农杆菌,将靶基因转移并掺入宿主植物的基因组中,产生转基因发根[7]。发根农杆菌侵染植物所产生的发根具有生长速度快、分化程度高、生理生化和遗传性稳定、易于进行操作控制等特点[8]。
解决的关键问题:
为木本植物物种开发了一种简单、快速、高效的根系转化系统,并对其基因进行功能鉴定。
实验思路与结果解读:
(1)实验材料
豌豆种子来自中国东北林业大学,文章中其它经济作物的种子来自北京林业大学。将种子用0.1%氯化汞表面灭菌5-10分钟,然后用无菌水洗涤五次。随后,在使用前将种子在MS培养基中培养约1-2个月后,将植物移植到10厘米(直径)×9厘米(高)盆中的土壤中,盆中含有土壤和沙子(体积比为3:1),并在25℃的高湿度环境中光照16小时、黑暗8小时下培养生长,待用。根据前期预实验,在一定的苗龄下注入发根农杆菌(K599、MSU440、C58C1和ArA4)[9]。
(2)在豌豆中诱导转基因毛状根
将构建的载体导入发根农杆菌菌株中,然后注入15日苗龄的豌豆幼苗(图2A)。生长约7-14天后,愈伤组织出现在注射部位周围并逐渐扩大(图2B和2C)。大约三周后,从愈伤组织中生长出类似于不定根的小毛状根(图2D)。一到两个月后,毛状根发达,可以单独支持整株植物(图2E)。在这个阶段,检测到目标基因已经通过RT-PCR或使用蛋白质印迹成功地引入到这些毛状根中。在确认转基因发根后,切下原始根,并且整个植物仅由转基因发根支撑(图2F)。这为基因功能分析、次级代谢物工程和植物应激反应的研究提供了快速和有效的方法。
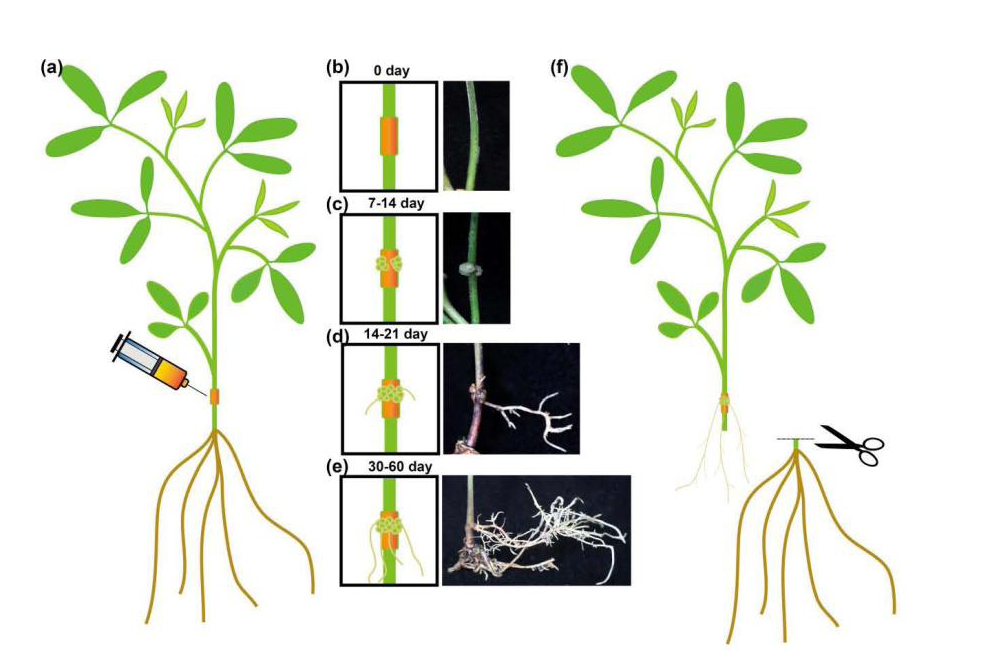
图2 豌豆的毛状根转基因培养体系
(3)农杆菌菌株、注射浓度和注射部位的选择
为了选择一种具有高转化效率的发根农杆菌菌株,在豌豆幼苗中测试发根农杆菌菌株K599、MSU440、C58C1和ArA4的转化率。将具有GFP质粒的不同土壤杆菌溶液注入15日龄的幼苗中以诱导毛状根。结果表明,发根农杆菌菌株K599在所有测试菌株中表现出最高的愈伤组织(80%)和根(30%)诱导效率(p<0.05)。
测试了不同浓度的农杆菌溶液(OD600值为0.2、0.3、0.4、0.5和0.6)对愈伤组织诱导率、毛状根诱导率和转基因率的影响。结果表明,OD600为0.3和0.4对于获得豌豆幼苗的愈伤组织高诱导率是最佳的(p<0.05),OD600为0.3显示出毛状根的最佳再生率(p<0.05),不同土壤杆菌溶液浓度之间的转基因根率没有差异。且PCR和GFP荧光表达证实靶基因已转移到毛状根中。
将靠近豌豆下胚轴的茎部分成三部分,每部分为0.5厘米。这些被部位从上到下分别命名为位置A、B和C(图3)。对于位置B和C,愈伤组织和毛状根的诱导率约为60%,而对于A则显着较低。使用三个不同年龄(15天,30天或45天)的幼苗来确定注射用幼苗的最佳年龄。结果表明,15日龄和30日龄幼苗的诱导率高于45日龄幼苗。
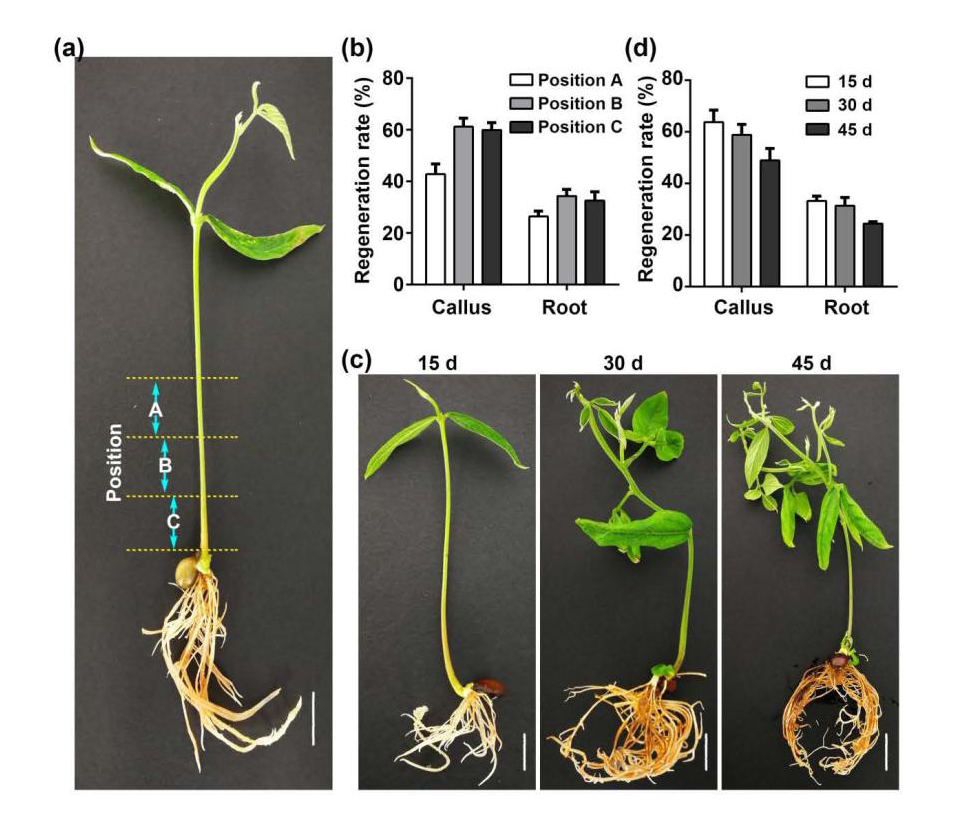
图3 农杆菌注射部位与苗龄的选择
(4)毛状根转基因方法对其他经济上重要的植物的适用性研究
该研究进一步扩展到湖北海棠、亚洲海棠、Gala苹果,红花、决明子、板蓝根、金花葵、秋葵、蓖麻、锦鸡儿及白木香等木本和草本的经济及药用植物中(图4)。结果表明,除了决明子、蓖麻和白木香外,其它9种植物都成功产生了毛状根。毛状根再生率在15%-45%之间,愈伤组织再生率在16%-85%之间变化, RT-PCR和蛋白质印迹证实靶基因(GFP)在转基因发根中表达。这些结果表明毛状根方法具有从草药到木本植物的广泛应用范围。

图4 其他经济植物毛状根转基因系统的建立
(5)基因表达分析功能的验证
为了进一步证实这里针对多种植物物种开发的毛状根系统适合于进行基因的功能分析,在RT-PCR和GFP荧光表达验证功能基因后,对毛状根系统进行双分子荧光互补分析(BIFC)。从豌豆根中克隆CcCIPK1、CcCIPK14、CcCBL1和CcCBL2基因,随后,将含有目标基因的载体转移到发根土壤杆菌中并注入幼苗茎中。在培养转基因毛状根约一个月后,通过荧光显微镜检测荧光信号。为了确认毛状根系统中的BiFC结果,对CIPK14和CBL1/CBL2进行酵母双杂交测定(图5)。结果表明CIPK14分别与CBL1和CBL2结合,阴性对照是CIPK6+CBL1、CIPK14+YFPn、YFPc+CBL1,其未显示荧光信号。通过蛋白质免疫印迹HA-或Myc-标签表明蛋白质在所有毛状根系中成功表达。酵母双杂交测定中,CIPK14与CBL1和CBL2相互作用,与BiFC测定中结果一致。
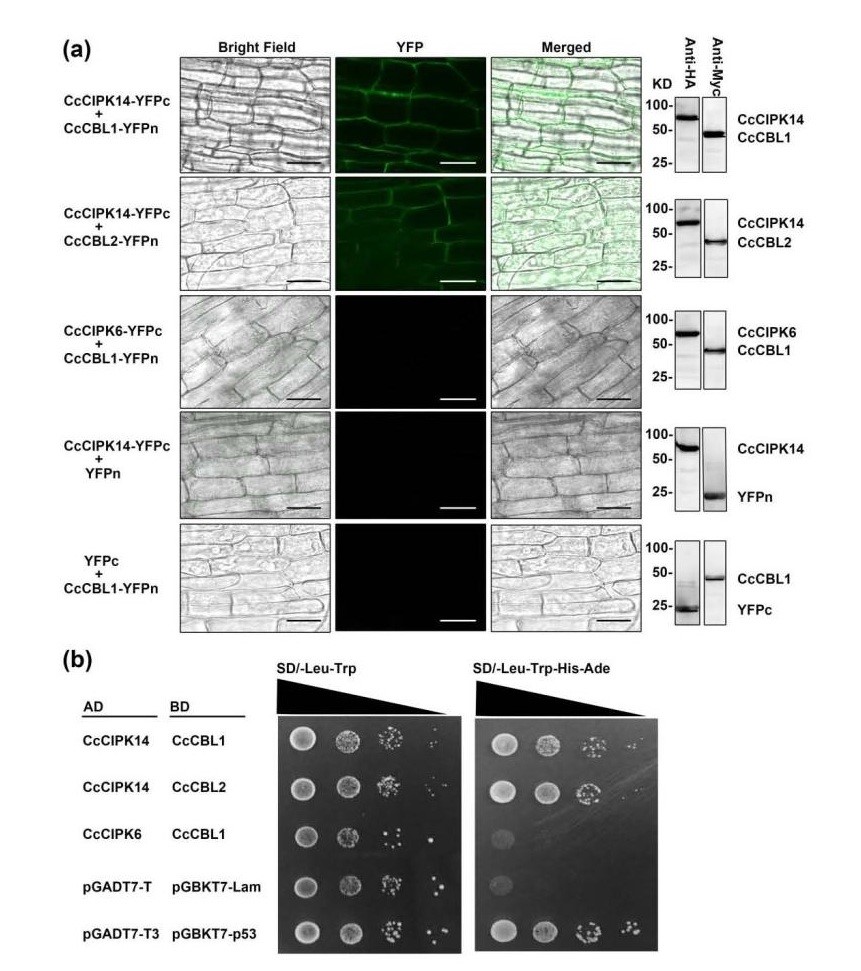
图5 功能基因表达分析的验证
(6)苹果花青素代谢调控分析
研究表明,MzHY5是一种bZIP转录因子,可调节苹果中的花青素合成[10]。本研究中采用了根转基因方法克隆了该基因并在'Gala'中过表达,在两个转基因品系中,MdHY5的表达水平增加2.5至3倍(图6)。为了证实MdHY5的作用,还使用RT-qPCR检测其花青素途径中的靶基因的表达水平,包括MdCHS、MdCHI、MdF3H、MdDFR、MdUFGT,发现这些基因的表达均被上调。这些结果表明,毛状根转基因系统可以成功地用于研究植物次生代谢,并提供一种简单快速的方法来验证基因在草本和木本植物中的功能。
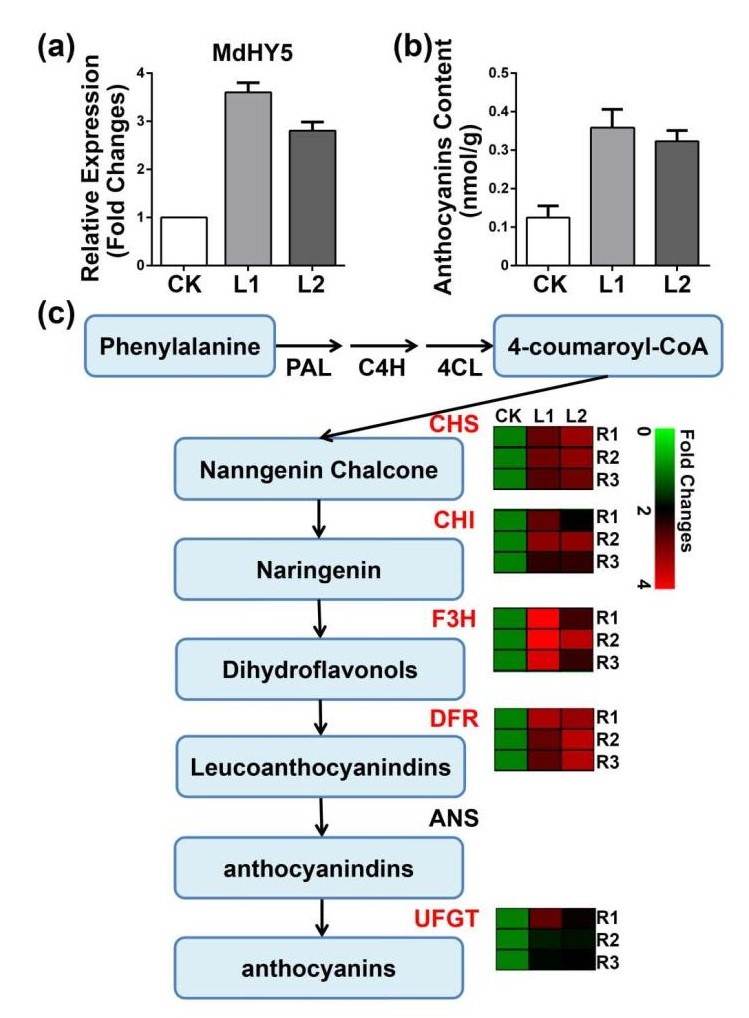
图6 毛状根转基因培养后苹果花青素代谢调控分析
实验结论:
将发根农杆菌注入各种植物的茎中导致稳定的转基因根生成,其可以在原始的非转基因根被切断后维持植物生长。在优化了发根农杆菌菌株的选择、细菌浓度、注入位置和幼苗龄期后,建立了木本豌豆的转化系统。在传统毛状根培养方法的基础上,对4种发根农杆菌菌株进行了检测,确定了农杆菌K599在木豆中具有较高的根诱导率,RT-PCR和GFP荧光表达证明了基因在诱导的根中表达,考察了不同育苗条件对转基因根诱导率的影响,并利用BIFC、蛋白质免疫印迹和酵母双杂交手段验证了转基因毛状根的基因表达分析功能。同时,该研究进一步扩展到其它草本和木本的经济及药用植物中,成功获得了多种植物根部转基因系统。建立了一个简单,快速,高效的根系转化系统,为生长周期长的木本植物的研究提供了重要的关键技术体系,对林木次生代谢产物代谢调控和育种研究具有重要的科学价值及应用价值。
参考文献:
[1] VAIN P. Thirty years of plant transformation technology development [J]. Plant Biotechnology Journal, 2010, 5 (2): 221-229.
[2] 天然的转基因甘薯 [J]. 泸州科技, 2015, (2): 17-17.
[3] 王臣臣, 王丽华, 刘言龙, 等. 提高作物转基因效率方法研究进展 [J]. 分子植物育种, 2019, (11): 3585-3592.
[4] XIUREN Z, ROSSANA H, SHIH-SHUN L, et al. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method [J]. Nature Protocols, 2006, 1 (2): 641-646.
[5] WENZLER H, MIGNERY G, MAY G, et al. A rapid and efficient transformation method for the production of large numbers of transgenic potato plants [J]. Plant Science, 1989, 63 (1): 79-85.
[6] GELVIN S B. Agrobacterium-mediated plant transformation: the biology behind the "gene-jockeying" tool [J]. Microbiology & Molecular Biology Reviews Mmbr, 2003, 67 (1): 16-37.
[7] OZYIGIT I I, DOGAN I, TARHAN E A. Agrobacterium rhizogenes -Mediated Transformation and Its Biotechnological Applications in Crops [J]. Crop Improvement, 2013, 1-47.
[8] SHAJAHAN A, THILIP C, FAIZAL K, et al. An Efficient Hairy Root System for Withanolide Production in Withania somnifera (L.) Dunal [J]. Production of Plant Derived Natural Compounds through Hairy Root Culture, 2017, 133-143.
[9] MENG D, YANG Q, DONG B, et al. Development of an efficient root transgenic system for pigeon pea and its application to other important economically plants [J]. Plant Biotechnology Journal, DOI, 101111/pbi13101.
[10] ABRAHAM J, THOMAS T D. Hairy Root Culture for the Production of Useful Secondary Metabolites [J]. Biotechnology and Production of Anti-Cancer Compounds 2017, 201-230.
(编辑:黄慧敏,发布日期:2019-07-08)
